在胚胎發育的最早期階段,血管和血細胞是由共同的祖細胞形成的。在一種遺傳程序中,血液和血管形成的時機和方式受到多種基因的調節。這種遺傳程序的特征是類似級聯反應的基因活性激活模式。
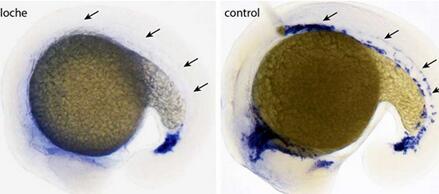
Reischauer說,在上世紀90年代中期,那時Stainier還在美國,他就發現模式生物斑馬魚的一種突變體“擁有迄今為止發現的最為令人關注的發育缺陷之一”。由于這種斑馬魚發生一種基因變化,參與血細胞和血管細胞遺傳程序的多種基因沒有一種被激活。因此,這些細胞不能夠產生。因為這種斑馬魚突變體的另一種獨特的特征:類似鐘形女帽(cloche)的心臟形狀,Stainier將它稱作為clothe。
在過去的二十年中,世界各地的許多實驗室參與尋找導致這種斑馬魚突變體產生的基因。Reischauer說,“對我們所有人來說,鑒定出Cloche基因就像是解決了幾十年未曾解決的遺傳學刑事案件。然而,在這項研究中,它不是罪犯是未知的,而是受害者—即存在缺陷的基因---是未知的。”如今,Stainier團隊與國際合作者一道成功地找到了這種基因。
隱藏在染色體末端的‘保護帽’中
Reischauer說,“由于Cloche基因位于13號染色體的最末端,也就是位于端粒區中,這就使得這種尋找非常復雜。”如今,利用只有最近才能使用的方法(比如,CRISPR/Cas9和TALEN),研究人員擁有分析這些區域的工具。Reischauer說,“此外,我們曾不得不假設這種基因僅在血管生長明顯缺乏的時間之前是有活性的。這就使得更難識別出存在缺陷的胚胎。”
在這項新的研究中,研究人員首先研究了他們猜測Cloche基因在基因組中所在的整個區域。通過分析26,000種基因的數據,他們鑒定出17種基因可能是潛在的候選物。接著,他們通過產生基因敲除系(knockout line)分別地讓這17種基因失活,并研究了這些基因敲除系產生的胚胎中的血管生長。Reischauer說,“僅在一種胚胎中,我們發現了期待的情形,也就是不能夠誘導血管生長。這樣,我們才確信我們已找到Cloche基因。”
在進一步的實驗中,研究人員發現Cloche基因對胚胎中的血管和血細胞產生是多么重要:經證實之前已知參與血管形成的所有基因僅在Cloche基因有活性時才有活性。因此,Cloche基因本身控制著這整個遺傳程序的活性。
這種情形也在所謂的過表達實驗中得到證實,在這種實驗中,研究人員將純的Cloche mRNA注射到胚胎中。這種方法能夠讓這些胚胎在它們發育期間的某個在正常情形下Cloche基因是沒有活性的時刻開啟血管和血細胞形成程序。Stainier說,“因此,我們能夠提出我們發現負責控制這種發育程序的基因。”
Cloche基因似乎在自然界中是高度保守的:這種基因甚至也存在于鳥類中。在哺乳動物中,也存在一種密切相關的基因能夠接管這種斑馬魚模式生物中的Cloche基因功能。因此,研究人員假設“隨著鑒定出這種基因和它的功能,將有巨大的機會開發出用于個人化干細胞治療的新應用”。
(科順生物www.wipwgqi.cn)